在糖尿病管理领域,持续葡萄糖监测(CGM)技术的应用曾长期局限于胰岛素治疗人群,尤其是1型糖尿病患者及需强化胰岛素治疗的2型糖尿病(T2DM)患者。这类人群因低血糖风险高、血糖波动大,传统指尖采血监测频次难以满足临床需求,CGM的连续监测优势得以凸显。在2025年美国糖尿病协会(ADA)年会上,多项研究摘要揭示了CGM在非胰岛素治疗的T2DM患者中的应用效果,涵盖血糖控制、生活方式管理以及患者心理等多方面影响。本文将基于这些研究发现,阐述CGM在这类人群中的应用进展,以期为临床决策提供参考。

CGM助力血糖精准调控:证据与发现
传统的糖尿病饮食教育常面临依从性低、效果个体差异大的挑战。然而,多项研究一致证实,引入CGM可显著改善非胰岛素治疗T2DM患者的血糖控制指标。
个性化饮食指导:基于CGM的血糖管理新路径
一项针对124例非胰岛素治疗T2DM患者的随机对照试验,比较了在CGM启动期间,营养导向型干预(NFA,接受个性化饮食指导)与自我导向型干预(SDA,仅接受标准教育)的疗效差异。评估指标包括葡萄糖目标范围内时间(TIR)、饮食质量(HEI评分)和糖尿病痛苦量表。结果显示,两组的TIR均显著改善(NFA组:+25%,SDA组:+16%),但组间无显著差异(P=0.14)(图1)。NFA组>250 mg/dl时间减少更显著(-14% vs. -6%,P=0.047)。此外,NFA组饮食质量提高(HEI评分:+5分),而SDA组无变化。并且,NFA组对使用CGM的信心提升相较于SDA组更高(35% vs. 9%,P=0.02)[1]。
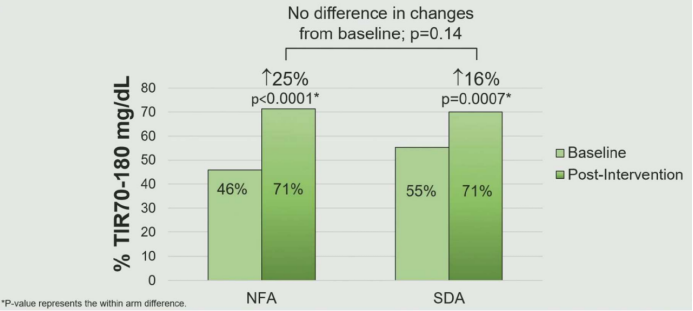
图1. NFA组和SDA组的TIR改变
另一项针对新诊断T2DM患者的随机对照研究显示,基于CGM数据的个性化饮食建议对患者的血糖控制与自我管理效能有显著改善作用。该研究将108例患者随机分为标准饮食教育组与CGM干预组。干预组通过可穿戴CGM设备监测1周,结合数字平台动态分析血糖波动规律,并据此提供定制化饮食反馈。3个月后,干预组糖化血红蛋白(HbA1c)降幅较对照组更显著(P=0.02),糖尿病自我管理行为量表(DSCSA)评分(P<0.001)和患者满意度显著提高(P=0.03)。亚组分析提示,年轻、高体重及基线血糖水平较高者获益更显著[2]。
数字化干预的"剂量-反应"关系
此外,一项对数字糖尿病自我管理教育与支持(DSMES)与CGM整合方案的随机对照试验的二次分析表明,患者对方案的参与度与HbA1c的降低幅度密切相关。具体而言,总参与度处于平均水平的受试者从基线到6个月HbA1c降低1.08%(P<0.001),葡萄糖高于目标范围时间(TAR)降低16.63%(P=0.002),TIR增加16.54%(P=0.001)。总参与度高(+1 SD)的受试者HbA1c降低1.71%(P<0.001),葡萄糖管理指标(GMI)降低1.37%(P<0.001),TAR降低32.92%(P<0.001),平均血糖降低56.41 mg/dl(P<0.001),TIR增加32.86%(P<0.001);而参与度低(-1 SD)受试者的各指标无显著变化。由此可见,更高参与度的数字DSMES与CGM整合方案有望带来更佳长期糖尿病管理效果[3]。
CGM在多元人群中的普适性获益
一项纳入241例非胰岛素治疗的T2DM患者的全球注册研究的初步结果显示,在基层医疗场景中使用CGM与HbA1c改善相关。研究发现,CGM使用与3、6个月时HbA1c显著改善,3个月时体重和BMI下降,以及2~6个月TIR、TAR和平均血糖改善相关(表1)[4]。
表1. 全球注册研究中基于HbA1c、体重和CGM的结果

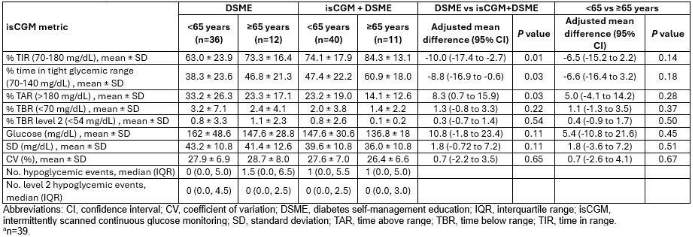
针对老年非胰岛素治疗T2DM患者的亚组分析显示,无论患者年龄如何(≥65岁或<65岁),在糖尿病自我管理教育(DSME)基础上使用间歇扫描式CGM(isCGM)均可增加TIR(表2),为CGM在老年非胰岛素治疗T2DM患者中的应用提供了有力支持[5]。
表2. 按年龄分层后isCGM+DSME的结果
在探索最新技术的研究中发现,使用结合人工智能(AI)食品识别技术的isCGM方案,可使HbA1c在6个月时下降0.34%(P=0.041),且严格的葡萄糖目标范围内时间(TITR)也有改善的趋势(P=0.086)(图2)[6]。

图2. isCGM+AI对HbA1c和TIR的影响
这些证据表明,CGM能够助力非胰岛素治疗的糖尿病患者获得更好的整体血糖控制,有效降低HbA1c水平,这对于预防糖尿病并发症具有重要的临床意义。
CGM 驱动生活方式变革:从短期洞察到长期习惯养成
CGM的价值不仅体现在血糖指标的改善上,更在于其能显著提升患者对生活方式与血糖关系的认知,进而促进健康行为的长期改变。
短期使用CGM的“觉醒效应”
在丹麦开展的一项研究中,纳入724例非胰岛素治疗T2DM患者,为其提供14天CGM设备,并仅给予最低限度的指导。结果显示,大部分(80%)患者认为CGM非常有用且信息丰富。与病程>5年者相比,病程<5年者每日扫描频率更高(80% vs. 71%),且能更清晰识别食物种类(88% vs. 78%)、摄入量(80% vs. 60%)和运动(65% vs. 55%)对血糖的影响。3个月后,50%的患者维持了基于CGM洞察的饮食/运动习惯。这些发现表明,即使短期的CGM使用,也能促进患者理解生活方式对血糖的影响,且这一效果不受教育水平限制[7]。
CGM对自我管理行为的积极影响
一项针对156例非胰岛素治疗T2DM患者的真实世界观察研究显示,CGM使用3个月后,患者在饮食和运动方面的自我管理行为均有改善。具体而言,患者报告的糖尿病相关困扰显著减少,含糖饮料、甜点和酒精的摄入量明显减少,而对健康饮食计划和运动锻炼的依从性有所提高(均P<0.05)。同时,年轻患者(<45岁)的TIR从最初10天的68%提升到最后10天的86%,血糖高于250 mg/dl的时间从13%降至2%,展现出显著的血糖改善。女性患者在佩戴CGM期间糖尿病相关困扰较基线显著降低。这些数据表明,CGM不仅提供客观的血糖信息,还能在心理层面减轻患者的负担,增强自我管理的信心和动力[8]。
CGM 应用拓展:特殊人群中的突破
新生儿低血糖是导致神经发育障碍的重要风险因素,但传统的床旁血糖即时检测(POC)可能遗漏25%的低血糖事件。结果表明,通过引入一种实时重校准算法,仅需在佩戴传感器的第一天使用2次POC测量值进行校准,即可将CGM的平均绝对相对误差(MARD)从40%降至12%,平均符号误差从25 mg/dl降至3.5 mg/dl,显著提升了准确性[9]。
针对ICU中危重患者的研究显示,总体MARD为23%,41%的传感器数值符合15/15准则。传感器倾向于高估血糖值,平均差值为+25 mg/dl。然而,无论患者是否存在糖尿病、是否使用静脉胰岛素或是否使用血管加压药物,对CGM的准确性并无显著影响[10]。
小结
从胰岛素治疗患者的“刚需工具”到非胰岛素治疗患者的“预防性武器”,CGM的应用扩展标志着糖尿病管理从“反应性干预”向“前瞻性防控”的转型。其核心价值不仅在于数据采集,更在于通过实时反馈、AI分析和行为干预构建闭环管理生态。展望未来,随着技术进步和应用范围的进一步拓展,CGM有望成为全球糖尿病患者血糖管理的核心工具,为提升健康结局作出更大贡献。
参考文献
(上下滑动可查看)
[1] Holly J. Willis, et al. 234 OR: Impact of Initiating Continuous Glucose Monitoring in People with Type 2 Diabetes Not on Insulin: A Randomized Controlled Trial. ADA 2025.
[2] Heng Wan, et al. 6-OR: The Effectiveness of Personalized Dietary Advice Based on CGM Data for Newly Diagnosed Patients with Type 2 Diabetes. ADA 2025.
[3] Jeanean B. Naqvi, et al. 157-OR: Higher Engagement with a Digital DSMES + CGM Program Is Associated with More Robust Improvements in Glycemic Control. ADA 2025.
[4] Amir Herman, et al. 1495-P: Improved A1C in People with Non–Insulin-Treated T2D Using CGM in Primary Care—The Dexcom Global Registry. ADA 2025.
[5] Caity Decara, et al. 1025-P: Effect of Intermittently Scanned Continuous Glucose Monitoring in Older Adults with Type 2 Diabetes on Noninsulin Therapy—A Post Hoc Analysis of a Randomized Clinical Trial. ADA 2025.
[6] Sun Joon Moon, et al. 1029-P: Periodic Use of Intermittently Scanned CGM with AI Food Camera in Non-insulin-Treated Type 2 Diabetes—A Randomized Clinical Trial. ADA 2025.
[7] Emma Munch Nielsen, et al. 8-OR: Short-Term Continuous Glucose Monitoring Reveals Insights and Promotes Behavioral Awareness in People with Non-Insulin-Treated Type 2 Diabetes, Even after Minimal Instructions. ADA 2025.
[8] Margaret A. Crawford, et al. 1927-LB: Real-World Dexcom CGM Use in T2D NIT—Reduced Diabetes Distress and Improved Self-Care Behaviors. ADA 2025.
[9] Francesco Prendin, et al. 230-OR: A Real-time Recalibration Algorithm To Improve The Accuracy Of CGM Sensors In Newborns. ADA 2025.
[10] Jagdeesh Ullal. 231-OR: Dexcom G6 Pro Accuracy and Reproducibility in the Intensive Care Unit. ADA 2025.
2 comments

CGM助力血糖精准调控:证据与发现
传统的糖尿病饮食教育常面临依从性低、效果个体差异大的挑战。然而,多项研究一致证实,引入CGM可显著改善非胰岛素治疗T2DM患者的血糖控制指标。
个性化饮食指导:基于CGM的血糖管理新路径
一项针对124例非胰岛素治疗T2DM患者的随机对照试验,比较了在CGM启动期间,营养导向型干预(NFA,接受个性化饮食指导)与自我导向型干预(SDA,仅接受标准教育)的疗效差异。评估指标包括葡萄糖目标范围内时间(TIR)、饮食质量(HEI评分)和糖尿病痛苦量表。结果显示,两组的TIR均显著改善(NFA组:+25%,SDA组:+16%),但组间无显著差异(P=0.14)(图1)。NFA组>250 mg/dl时间减少更显著(-14% vs. -6%,P=0.047)。此外,NFA组饮食质量提高(HEI评分:+5分),而SDA组无变化。并且,NFA组对使用CGM的信心提升相较于SDA组更高(35% vs. 9%,P=0.02)[1]。

图1. NFA组和SDA组的TIR改变
另一项针对新诊断T2DM患者的随机对照研究显示,基于CGM数据的个性化饮食建议对患者的血糖控制与自我管理效能有显著改善作用。该研究将108例患者随机分为标准饮食教育组与CGM干预组。干预组通过可穿戴CGM设备监测1周,结合数字平台动态分析血糖波动规律,并据此提供定制化饮食反馈。3个月后,干预组糖化血红蛋白(HbA1c)降幅较对照组更显著(P=0.02),糖尿病自我管理行为量表(DSCSA)评分(P<0.001)和患者满意度显著提高(P=0.03)。亚组分析提示,年轻、高体重及基线血糖水平较高者获益更显著[2]。
数字化干预的"剂量-反应"关系
此外,一项对数字糖尿病自我管理教育与支持(DSMES)与CGM整合方案的随机对照试验的二次分析表明,患者对方案的参与度与HbA1c的降低幅度密切相关。具体而言,总参与度处于平均水平的受试者从基线到6个月HbA1c降低1.08%(P<0.001),葡萄糖高于目标范围时间(TAR)降低16.63%(P=0.002),TIR增加16.54%(P=0.001)。总参与度高(+1 SD)的受试者HbA1c降低1.71%(P<0.001),葡萄糖管理指标(GMI)降低1.37%(P<0.001),TAR降低32.92%(P<0.001),平均血糖降低56.41 mg/dl(P<0.001),TIR增加32.86%(P<0.001);而参与度低(-1 SD)受试者的各指标无显著变化。由此可见,更高参与度的数字DSMES与CGM整合方案有望带来更佳长期糖尿病管理效果[3]。
CGM在多元人群中的普适性获益
一项纳入241例非胰岛素治疗的T2DM患者的全球注册研究的初步结果显示,在基层医疗场景中使用CGM与HbA1c改善相关。研究发现,CGM使用与3、6个月时HbA1c显著改善,3个月时体重和BMI下降,以及2~6个月TIR、TAR和平均血糖改善相关(表1)[4]。
表1. 全球注册研究中基于HbA1c、体重和CGM的结果

针对老年非胰岛素治疗T2DM患者的亚组分析显示,无论患者年龄如何(≥65岁或<65岁),在糖尿病自我管理教育(DSME)基础上使用间歇扫描式CGM(isCGM)均可增加TIR(表2),为CGM在老年非胰岛素治疗T2DM患者中的应用提供了有力支持[5]。
表2. 按年龄分层后isCGM+DSME的结果

在探索最新技术的研究中发现,使用结合人工智能(AI)食品识别技术的isCGM方案,可使HbA1c在6个月时下降0.34%(P=0.041),且严格的葡萄糖目标范围内时间(TITR)也有改善的趋势(P=0.086)(图2)[6]。

图2. isCGM+AI对HbA1c和TIR的影响
这些证据表明,CGM能够助力非胰岛素治疗的糖尿病患者获得更好的整体血糖控制,有效降低HbA1c水平,这对于预防糖尿病并发症具有重要的临床意义。
CGM 驱动生活方式变革:从短期洞察到长期习惯养成
CGM的价值不仅体现在血糖指标的改善上,更在于其能显著提升患者对生活方式与血糖关系的认知,进而促进健康行为的长期改变。
短期使用CGM的“觉醒效应”
在丹麦开展的一项研究中,纳入724例非胰岛素治疗T2DM患者,为其提供14天CGM设备,并仅给予最低限度的指导。结果显示,大部分(80%)患者认为CGM非常有用且信息丰富。与病程>5年者相比,病程<5年者每日扫描频率更高(80% vs. 71%),且能更清晰识别食物种类(88% vs. 78%)、摄入量(80% vs. 60%)和运动(65% vs. 55%)对血糖的影响。3个月后,50%的患者维持了基于CGM洞察的饮食/运动习惯。这些发现表明,即使短期的CGM使用,也能促进患者理解生活方式对血糖的影响,且这一效果不受教育水平限制[7]。
CGM对自我管理行为的积极影响
一项针对156例非胰岛素治疗T2DM患者的真实世界观察研究显示,CGM使用3个月后,患者在饮食和运动方面的自我管理行为均有改善。具体而言,患者报告的糖尿病相关困扰显著减少,含糖饮料、甜点和酒精的摄入量明显减少,而对健康饮食计划和运动锻炼的依从性有所提高(均P<0.05)。同时,年轻患者(<45岁)的TIR从最初10天的68%提升到最后10天的86%,血糖高于250 mg/dl的时间从13%降至2%,展现出显著的血糖改善。女性患者在佩戴CGM期间糖尿病相关困扰较基线显著降低。这些数据表明,CGM不仅提供客观的血糖信息,还能在心理层面减轻患者的负担,增强自我管理的信心和动力[8]。
CGM 应用拓展:特殊人群中的突破
新生儿低血糖是导致神经发育障碍的重要风险因素,但传统的床旁血糖即时检测(POC)可能遗漏25%的低血糖事件。结果表明,通过引入一种实时重校准算法,仅需在佩戴传感器的第一天使用2次POC测量值进行校准,即可将CGM的平均绝对相对误差(MARD)从40%降至12%,平均符号误差从25 mg/dl降至3.5 mg/dl,显著提升了准确性[9]。
针对ICU中危重患者的研究显示,总体MARD为23%,41%的传感器数值符合15/15准则。传感器倾向于高估血糖值,平均差值为+25 mg/dl。然而,无论患者是否存在糖尿病、是否使用静脉胰岛素或是否使用血管加压药物,对CGM的准确性并无显著影响[10]。
小结
从胰岛素治疗患者的“刚需工具”到非胰岛素治疗患者的“预防性武器”,CGM的应用扩展标志着糖尿病管理从“反应性干预”向“前瞻性防控”的转型。其核心价值不仅在于数据采集,更在于通过实时反馈、AI分析和行为干预构建闭环管理生态。展望未来,随着技术进步和应用范围的进一步拓展,CGM有望成为全球糖尿病患者血糖管理的核心工具,为提升健康结局作出更大贡献。
参考文献
(上下滑动可查看)
[1] Holly J. Willis, et al. 234 OR: Impact of Initiating Continuous Glucose Monitoring in People with Type 2 Diabetes Not on Insulin: A Randomized Controlled Trial. ADA 2025.
[2] Heng Wan, et al. 6-OR: The Effectiveness of Personalized Dietary Advice Based on CGM Data for Newly Diagnosed Patients with Type 2 Diabetes. ADA 2025.
[3] Jeanean B. Naqvi, et al. 157-OR: Higher Engagement with a Digital DSMES + CGM Program Is Associated with More Robust Improvements in Glycemic Control. ADA 2025.
[4] Amir Herman, et al. 1495-P: Improved A1C in People with Non–Insulin-Treated T2D Using CGM in Primary Care—The Dexcom Global Registry. ADA 2025.
[5] Caity Decara, et al. 1025-P: Effect of Intermittently Scanned Continuous Glucose Monitoring in Older Adults with Type 2 Diabetes on Noninsulin Therapy—A Post Hoc Analysis of a Randomized Clinical Trial. ADA 2025.
[6] Sun Joon Moon, et al. 1029-P: Periodic Use of Intermittently Scanned CGM with AI Food Camera in Non-insulin-Treated Type 2 Diabetes—A Randomized Clinical Trial. ADA 2025.
[7] Emma Munch Nielsen, et al. 8-OR: Short-Term Continuous Glucose Monitoring Reveals Insights and Promotes Behavioral Awareness in People with Non-Insulin-Treated Type 2 Diabetes, Even after Minimal Instructions. ADA 2025.
[8] Margaret A. Crawford, et al. 1927-LB: Real-World Dexcom CGM Use in T2D NIT—Reduced Diabetes Distress and Improved Self-Care Behaviors. ADA 2025.
[9] Francesco Prendin, et al. 230-OR: A Real-time Recalibration Algorithm To Improve The Accuracy Of CGM Sensors In Newborns. ADA 2025.
[10] Jagdeesh Ullal. 231-OR: Dexcom G6 Pro Accuracy and Reproducibility in the Intensive Care Unit. ADA 2025.
2 comments










 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言